公司新闻 山东淄博新达制药有限公司
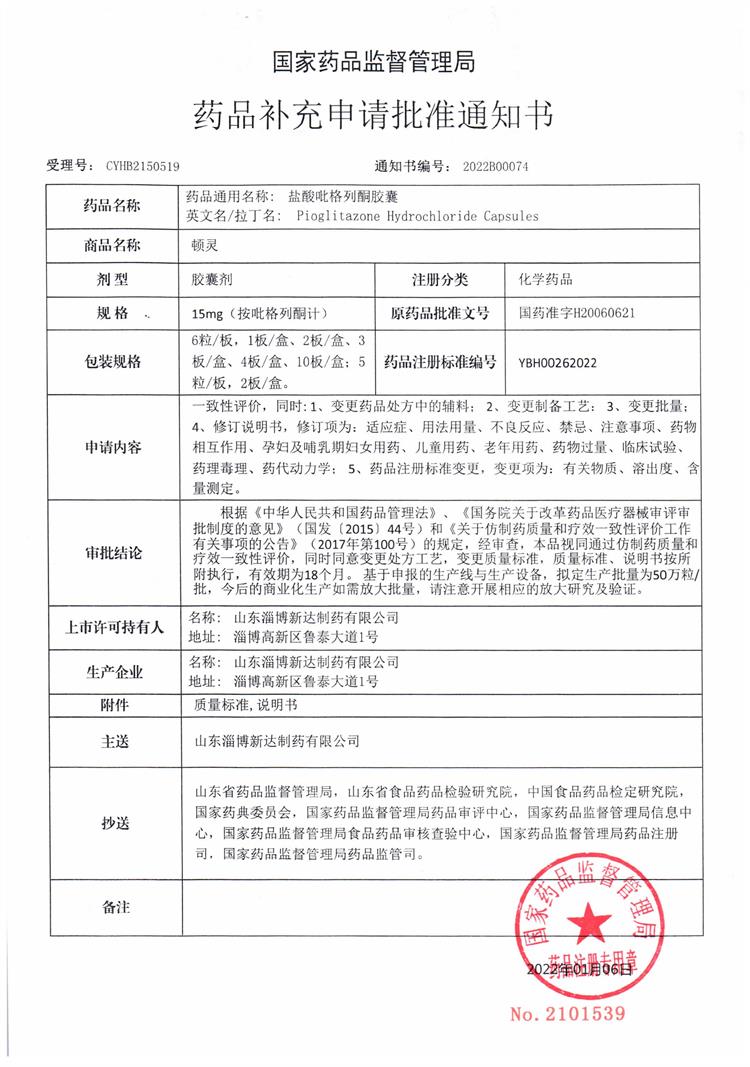
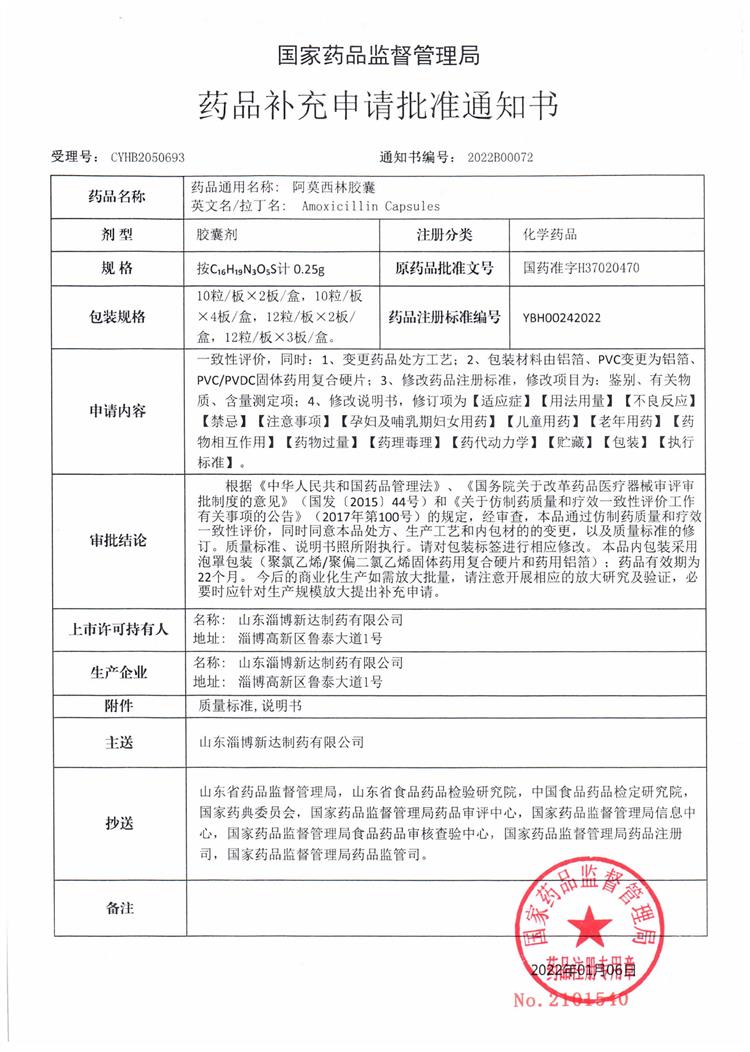
盐酸吡格列酮胶囊和阿莫西林胶囊通过仿制药质量和疗效一致性评价
发布时间:2022-01-19

盐酸吡格列酮由日本Takeda公司研发,最早于1999年7月在美国上市,主要用于2型糖尿病的治疗,已在澳大利亚、加拿大、日本、德国、丹麦、西班牙等多个国家上市,应用广泛。米内网数据显示,最近三年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端,盐酸吡格列酮片的销售额保持在5亿元以上,2020年吡格列酮胶囊在中国城市公立医院销售额为2.95亿元。
2021年3月,我公司向国家药品监督管理局CDE递交了盐酸吡格列酮胶囊(规格:15mg(按吡格列酮计))仿制药质量和疗效一致性评价申请并获受理,2021年09月收到CDE发出的补充研究通知,2021年11月公司完成补充研究工作并递交资料,2022年01月获得《药品补充申请批准通知书》,审评结论为通过仿制药质量和疗效一致性评价。目前我公司为第一家胶囊剂通过一致性评价的企业。
阿莫西林胶囊由GSK公司开发,并于1972年在英国上市,商品名Amoxil,后相继在美国、西班牙、日本等国上市。阿莫西林为青霉素类抗生素,对肺炎链球菌、溶血性链球菌等链球菌属、不产青霉素酶葡萄球菌、粪肠球菌等需氧革兰阳性球菌,大肠埃希菌、奇异变形杆菌、沙门菌属、流感嗜血杆菌、淋病奈瑟菌等需氧革兰阴性菌的不产β-内酰胺酶菌株及幽门螺杆菌具有良好的抗菌活性。
2020年11月,我公司向国家药品监督管理局CDE递交了阿莫西林胶囊(规格:按C16H19N3O5S计0.25g)仿制药质量和疗效一致性评价申请并获受理,2021年05月收到CDE发出的补充研究通知,2021年06月公司完成补充研究工作并递交资料,2022年01月获得《药品补充申请批准通知书》,审评结论为通过仿制药质量和疗效一致性评价。
两个品种的过评,有利于进一步提升该产品的市场竞争力,同时也保证了广大患者的用药安全与治疗疗效。
- 上一篇:工间风采我先行,新达融情一家亲
- 下一篇:情系职工送温暖、关怀备至暖人心



